Radioembolizzazione con Ittrio-90
Introduzione
La radioembolizzazione con ittrio-90 è una promettente modalità terapeutica, per la gestione di particolari tumori epatici; microparticelle in resina o in vetro, caricate con il radioisotopo radioattivo, vengono somministrate nell’arteria che rifornisce il tumore. Chiaramente consentono un controllo locale di tumori epatici giudicati non operabili chirurgicamente [Fig. 1].
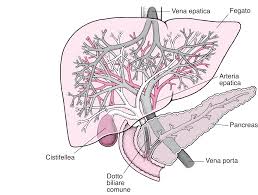
Fig. 1 – La vascolarizzazione del fegato. A differenza di altri organi, il fegato ha una doppia irrorazione: dall’arteria epatica riceve il 15-20%, mentre dalla vena porta accoglie il rimanente 85-80%. Gli epatocarcinomi, nella loro crescita, hanno dimostrato di diminuire progressivamente l’apporto ematico dalla vena porta, per aumentare quello dall’arteria epatica, sia quello diretto, sia attraverso altre comunicazioni indirette. Lo stesso fenomeno avviene anche per le metastasi epatiche, oltre i 3 mm di diametro trasverso, che derivano il loro apporto ematico prevalentemente dall’arteria epatica, anche se in modo meno vorticoso. Questi concetti di fisiopatologia oncologica costituiscono il presupposto per la somministrazione in loco di terapie mirate, direttamente solo all’interno del fegato. In particolare, nella radioembolizzazione sono presenti sia l’embolizzazione che la brachiterapia
Indicazioni
Visto che la sicurezza del trattamento è la priorità, la selezione dei pazienti deve essere molto accurata. Vengono trattati sia tumori primitivi che secondari, localizzati a livello epatico non sottoponibili alla resezione, in pazienti in buona classe funzionale, che non abbiano avuto una risposta alla chemioembolizzazione tradizionale e che non abbiano una diffusione metastatica extraepatica. Tra i tumori primitivi rientrano sia l’epatocarcinoma, che il colangiocarcinoma [Fig. 2].
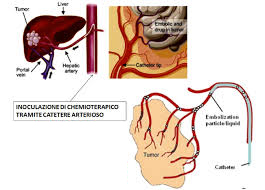
Fig. 2 – Chemioembolizzazione nei tumori primitivi. L’epatocarcinoma è una malattia complessa, dove le possibilità terapeutiche vengono influenzate dalla funzione epatica e dall’estensione della malattia – alcune soluzioni terapeutiche si sono dimostrate essere curative, sempre che il tumore sia di limitate estensioni. Purtroppo, molto spesso, la malattia è in stato localmente avanzato o in stadio metastatico, o con ridotta riserva funzionale o con comorbilità che limitano certe scelte – La resezione è indicata in un ristretto gruppo di pazienti; il trapianto è eseguibile tra coloro che rientrano nei criteri di Milano. La chemioembolizzazione e la termoablazione a radiofrequenza sono considerate terapie locoregionali, da impiegare nei pazienti non candidati alla chirurgia. In particolare, in tutti quei pazienti in cui la malattia tumorale ha comportato il coinvolgimento della vena porta. Questo si verifica in un 10-40% dei casi. Non sempre è ostruzione completa, non sempre è totalmente di origine tumorale. La sopravvivenza media di questi pazienti è 2-4 mesi, contro un 10-24 mesi dei pazienti senza trombosi. La trombosi della porta controindica la resezione, il trapianto, e la chemioembolizzazione. La radioembolizzazione, grazie al basso potere embolizzante, ma elevato potere radiante, si è dimostrata molto utile in questi casi
Quindi, l’indicazione è quella citoriduttiva, di miglioramento della qualità della vita e di aumentare la sopravvivenza. Nei casi dei pazienti in lista di trapianto di fegato, si è dimostrata utile per sotto stadiarli e garantire una maggiore permanenza in lista. Il presupposto è che ci sia una buona funzione epatica, un idoneo accesso arterioso e non ci sia uno shunt polmonare.
Nel caso dei tumori secondari, quello più frequente è la metastasi da carcinoma del colon retto Anche in questo campo le condizioni dei pazienti devono essere simili a quelli con tumori primitivi, così come i presupposti clinici e tecnici [Fig. 3].
Fig. 3 – Tumori secondari. Le metastasi epatiche da carcinoma del colon retto sono le più numerose. Possono essere presenti al momento della diagnosi della patologia intestinale, o svilupparsi dopo l’intervento chirurgico. Anche in questo caso, la resezione chirurgica, con intento curativo, è effettuabile in un numero ristretto di pazienti. La chemioterapia è effettuabile in tutti i casi, ma la risposta non è sempre soddisfacente. Le terapie loco-regionali hanno lo scopo di effettuare una citoriduzione e prolungare la sopravvivenza; la termoablazione, a radiofrequenza o a microonde, o la crioablazione hanno dimostrato notevole efficacia nel trattare queste lesioni. Ma la radioembolizzazione possiede un’azione più ampia, potendo affrontare una malattia plurifocale, uni o bilobare; talvolta, nel caso di un trattamento lobare, può provocare l’atrofia del lobo e l’ipertrofia di quello controlaterale, consentendo la successiva resezione chirurgica, prima non realizzabile
Controindicazioni
Presenza di ascite intrattabile, nonostante un adeguato supporto farmacologico, o d’insufficienza epatica. Diatesi emorragica non risolvibile. Severa arteriosclerosi che precluda il cateterismo arterioso. Ipertensione portale di grado elevato. Controindicazioni relative sono: piatrinopenia e anemia, bilirubina > 2,0 mg/dl, INR > 2 , creatinina > 2 mg/dl.
Valutazione pre-operatoria
Si compone di una parte clinica, di una ampia analisi di laboratorio, di una valutazione radiologica, diagnostica ed interventistica [Approfondimento 1]. Non ultima è quella del medico nucleare [Fig. 4, 5].

Fig. 4 – La valutazione medico nucleare. Al termine dello studio angiografico del fegato, viene somministrato tecnezio marcato, per valutare la presenza di shunt epatici verso il polmone. La successiva scintigrafia fornirà la prova dell’esistenza o meno di tale shunt, sia a livello polmonare che a livello gastroduodenale. A questo punto è possibile passare al calcolo della dose da somministrare al paziente, sulla base di formule matematiche per le Terasfere, su un calcolo empirico per le SIR sfere. Nel secondo caso, si consiglia l’iniezione di 3 GBq se il tumore occupa più del 50& del fegato. 2,5 GBq, se occupa tra il 25 e il 50% del fegato, 2 GBq, se occupa meno del 25%. Siccome non si sono registrate complicazioni, questo metodo è quello praticato, anche se potrebbe esserci un sottodosaggio, finalizzato a fare prevalere la sicurezza sull’efficacia – Se è presente uno shunt epatico verso il polmone, inferiore al 10%, non si applica una riduzione di dose del farmaco; se lo shunt è tra il 10 e il 15%, la dose è diminuita di un 20%; se lo shunt è tra 15 e 20%, la dose è ridotta di un 40%; sopra il 20% di shunt, il trattamento non è raccomandato
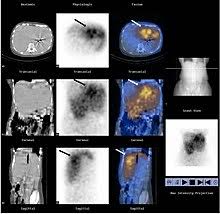
Fig. 5 – La figura del medico nucleare. Nell’era moderna, tende a prevalere una medicina personalizzata; questo vorrebbe dire modificare un’arte in una scienza. Occorre avere una scintigrafia integrata alla TC, per facilitare la riproducibilità dei risultati. La PET/TC rappresenta il superamento dei limiti avuti finora, con lo studio della deposizione del tecnezio (studio di simulazione di radioattività), che rappresenta la simulazione della successiva radioembolizzazione (angiografia esplorativa). Attualmente, lo studio della distribuzione della radioattività avviene secondo un modello che calcola la dose che si distribuisce nel fegato, quella nelle zone limitrofe e quella nel polmone, in frazioni rispetto alla dose totale somministrata. Sulla base di questa ripartizione è possibile stabilire la dose di radioattività che verrà assorbita, successivamente, dal paziente. Una ulteriore evoluzione è l’effettuazione di più arteriografie superselettive, a seconda del numero di arterie che contribuiscono ad irrorare il tumore, a cui, contestualmente, segue lo studio TC e la creazione di una mappa, che corrisponderà ad una personalizzata distribuzione delle successive dosi di radiofarmaco. Per le microsfere in vetro questo metodo non è applicabile, in quanto è prevista una iniezione globale nel fegato. Quindi, è possibile solo una differenziazione tra dose assorbita nel fegato e quella nel polmone. Siccome la dose che verrà somministrata deve essere la più sicura possibile, rispetto alla maggiore efficacia, può succedere che la quantità di tumore trattato sia inferiore alla massa globale di esso, oppure il margine di sicurezza può essere inferiore a quello auspicabile. Inoltre, se non si impiega la cone beam TC, l’effettuazione di una radioembolizzazione segmentale non è praticabile con efficacia, perché non si conosce il territorio di distribuzione di quel vaso arterioso. I dati di distribuzione della radioattività sono differenti tra microsfere in resina e vetro, per cui occorrono ulteriori elementi per calcolare la dose biologica effettiva (BED). Per avere una completa risposta nel tumore primitivo del fegato occorre superare i 120 Gy con le microsfere in resina; non si devono superare i 50 Gy nel fegato non tumorale e i 20 Gy nel polmone, per non avere complicazioni. Per quanto riguarda le metastasi da colon retto, si sono avute risposte complete, se la dose era superiore agli 80 Gy, risposte parziali, o assenza di risposta, se era inferiore a 30 Gy; chiaramente, la presenza di precedenti chemioterapie o la ridotta riserva funzionale epatica potrebbero comportare effetti minori anche a quelle dosi.. Per quanto riguarda le microsfere in vetro, alcuni autori hanno calcolato che una radioembolizzazione lobare ha una risposta positiva nel controllo del tumore, se viene superata la dose di 200Gy; non si hanno complicazioni nel fegato sano e nel polmone, se non vengono superate le dosi di 120 e 30 Gy. Altri autori hanno introdotto il concetto di TCP50 (probabilità di risposta del 50% del tumore), strettamente correlato alle dimensioni del tumore. Al di sotto di 10 cm3 di tumore, la dose efficace è 250 Gy, di 1000 Gy per lesioni maggiori. Le complicazioni epatiche nel fegato non tumorale avverrebbero a 75 Gy. Non esistono studi sui limiti di tali microsfere nel trattamento delle metastasi da colon retto – Anche sui ritrattamenti di radioembolizzazione sullo stesso territorio non esistono dati concreti per quanto riguarda le dosi somministrabili e gli intervalli temporali da osservare
Tecnica
Normalmente, l’intervento è effettuato in due sedute: la prima è l’angiografia esplorativa: dedicata allo studio angiografico del fegato, in cui s’inietta solo un tracciante: il tecnezio. Per questioni pratiche si preferisce effettuarla con un accesso transbrachiale, in modo che il paziente possa tornare a casa la sera stessa. A questa segue, dopo 1-2 ore, la valutazione scintigrafica dello shunt.
La seconda seduta viene effettuata quando il farmaco è disponibile, in genere 15-20 giorni dopo, con il rilascio delle particelle radioattive. [Fig. 6, 7] [Approfondimento 2].
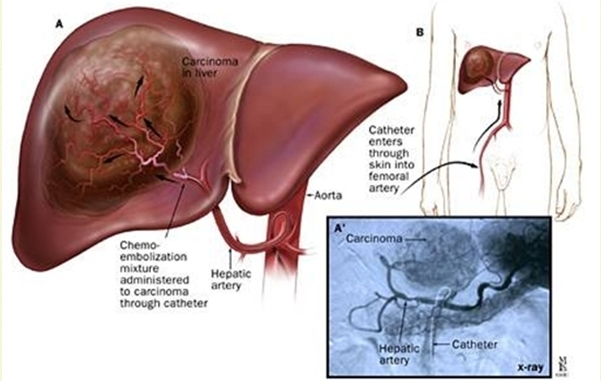
Fig. 6 – Arteriografia epatica.
Il cateterismo selettivo, o con il microcatetere ha proprio lo scopo di
confermare la sicurezza dell’intervento. Quindi, se fondamentali sono
la panoramica addominale, il cateterismo selettivo del tripode celiaco e
dell’arteria mesenterica superiore, con la visualizzazione del ritorno
portale, anche se questa non rappresenta una controindicazione,
altrettanto importante è lo studio del solo rifornimento arterioso
epatico.
Dal punto di vista procedurale, sarebbe meglio effettuare
prima lo studio della mesenterica superiore e poi del tripode, visto che
in questo si dovrà, generalmente, effettuare il cateterismo
superselettivo, per il ramo arterioso che rifornisce il tumore. Una
volta stabilizzato il microcatetere, da qui viene iniettato il
tracciante. In una seconda seduta, nello stesso punto dovrà essere
iniettato il radiofarmaco
Fig. 6 – Arteriografia epatica. Il
cateterismo selettivo, o con il microcatetere ha proprio lo scopo di
confermare la sicurezza dell’intervento. Quindi, se fondamentali sono la
panoramica addominale, il cateterismo selettivo del tripode celiaco e
dell’arteria mesenterica superiore, con la visualizzazione del ritorno
portale, anche se questa non rappresenta una controindicazione,
altrettanto importante è lo studio del solo rifornimento arterioso
epatico.
Dal punto di vista procedurale, sarebbe meglio effettuare
prima lo studio della mesenterica superiore e poi del tripode, visto che
in questo si dovrà, generalmente, effettuare il cateterismo
superselettivo, per il ramo arterioso che rifornisce il tumore. Una
volta stabilizzato il microcatetere, da qui viene iniettato il
tracciante. In una seconda seduta, nello stesso punto dovrà essere
iniettato il radiofarmaco
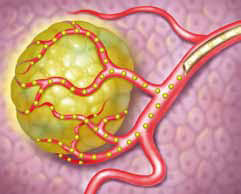
Fig. 7 – Agenti radioembolici. Esistono 2 tipi di carrier radioembolizzanti: le SIR sfere sono state approvate per l’impiego nelle metastasi epatiche, le Terasfere sono state approvate come adiuvante alla chirurgia o al trapianto per paziente con HCC, solo dopo il corretto posizionamento del catetere angiografico. Le Terasfere sono in vetro, hanno un calibro più piccolo, tra i 20 e i 30 micron, per cui hanno un’azione embolizzante più periferica e marcata; consentono di somministrate tra 3 e 20 GigaBequerel (GBq). Per trattamento vengono rilasciate fino a 8 milioni di particelle – Le SIR sfere sono in resina, hanno un diametro tra 20 e 60 micron, permettono di rilasciare fino a 3 GBq, per trattamento. Possono essere rilasciate fino a 30 milioni di particelle – l’ittrio 90 è un beta emittente, con una emivita di 64 ore; circa il 90% della dose trasportata viene rilasciata nell’arco di 11 giorni; dopo di che decade nello zirconio. Una volta penetrato in estrema periferia dei vasi, emette radiazioni per un raggio di 2,5 mm – L’indicazione inizialmente proposta era quella per i pazienti con trombosi della vena porta, che non potevano effettuare la chemioemboilizzazione
Nel caso in cui ci fosse una vicinanza tra le strutture operative, della medicina nucleare e della radiologia interventistica, tutto potrebbe essere effettuato nell’arco di un unico ricovero, nell’arco della stessa giornata: la radioembolizzazione in un’unica seduta. Il presupposto è di avere una dose standard di radiofarmaco, SIR sfere in genere, e che non ci sia lo shunt, per cui l’intervento può essere portato a termine; altrimenti il farmaco non può essere iniettato e il ricovero è annullato. Il vantaggio è solo nel massimo utilizzo dei posti letto e nel favorire i pazienti che provengono da fuori regione.
Complicazioni
Occorre fare una differenziazione tra sintomi legati alla tossicità del trattamento e le vere complicazioni. Tra i fenomeno legati alla tossicità dell’intervento rientrano la sindrome da post-embolizzazione, che è connaturata all’intervento. Poi ci sono la nausea, il vomito, la diarrea, la pancreatite: raramente assumono una rilevanza clinica, con un’adeguata preparazione prima dell’intervento. La loro persistenza nei giorni successivi è indicativo di una lesione secondaria al trattamento [Approfondimento 3].
Tra le complicazioni della radioembolizzazione rientrano tutte quelle che derivano dal rilascio di microsfere nelle strutture limitrofe alla massa epatica da trattare: la disfunzione epatica, le sequele biliari [Approfondimento 4]. Oppure in altri distretti anatomici [Approfondimento 5, 6, 7], quelli derivanti dall’impiego di mezzo di contrasto [Approfondimento 8], oppure quelli di natura vascolare [Approfondimento 9].
Gestione del post-intervento
Oltre al controllo dell’accesso femorale, anche in questo caso, la valutazione clinica, di laboratorio, radiologica e medico nucleare hanno il loro ruolo [Approfondimento 10]. La sopravvivenza media varia, a seconda del dato preso come parametro di valutazione. Nel paziente in classe A di Child, la sopravvivenza media è di 17 mesi [nel paziente senza trombosi portale è di 22 mesi, per dimezzarsi in caso di trombosi]; nel paziente in classe B è di 7 mesi [senza trombosi della porta è di 14 mesi, per scendere a 5 se è presente trombosi portale].
Raccomandazioni
Comprendere la storia clinica del paziente, con gli esami di laboratorio, per poterlo correttamente inquadrare; comprendere l’anatomia vascolare con lo studio angiografico, panoramico e di dettaglio; conoscere la posizione del catetere al momento del rilascio del tecnezio marcato.
Misurare l’entità dello shunt epato-polmonare con la SPET/TC, i volumi della massa epatica e dei tumori epatici con la cone-beam TC.
Decidere la dose limite per l’organo da trattare e comunicare la dose decisa al paziente, in modo che il trattamento sia il più sicuro possibile.
Accertarsi che la posizione del catetere, al momento del rilascio del farmaco radioattivo, sia la stessa dello studio preparatorio, in cui è stato iniettato il tecnezio.
Approfondimento 1
Nella valutazione pre-operatoria esiste una parte clinica, una di laboratorio, una parte radiologica e una del medico nucleare. La valutazione clinica e la scelta del paziente è il risultato di una riunione multidisciplinare, operata dall’epatologo, dall’oncologo, dal chirurgo dei trapianti, dal radiologo, sia diagnosta che interventista. L’anamnesi del paziente deve includere le precedenti terapie, gli accertamenti effettuati e gli interventi chirurgici subiti. Un pregresso intervento chirurgico sul fegato non rappresenta una controindicazione alla radioembolizzazione. Lo scopo di questa valutazione è quello di stabilire un punteggio esemplificativo, per capire la fattibilità dell’intervento. – La valutazione di laboratorio prevede che vengono effettuati i test di funzionalità epatica e renale, oltre alla valutazione ematochimica globale del paziente. Vengono effettuati anche i markers tumorali. In caso di cirrosi il paziente deve essere classificato sulla base del Child: bilirubina, albumina, INR, piastrine, encefalopatia, ascite. – La valutazione radiologica diagnostica prevede lo studio TC multistrato, con tecnica trifasica, e successive ricostruzioni, o/e RM. Queste due metodiche dinamiche consentono di fornire le seguenti informazioni: tipo di malattia in base al comportamento dopo somministrazione di mezzo di contrasto, senza dover ricorrere necessariamente alla biopsia, estensione della malattia, localizzazione della stessa, dimensione delle lesioni, vascolarizzazione delle lesioni, presenza o meno di varianti anatomiche di vascolarizzazione al fegato. – La valutazione di radiologia interventistica prevede l’effettuazione di una “angiografia esplorativa”. Questa consente di avere informazioni sull’anatomia vascolare del fegato, conferme o esclude la presenza di varianti anatomiche e l’esistenza di altri rami parassitari. Convalida quale sia il ramo che rifornisce il tumore. Inoltre permette di valutare, con il cateterismo selettivo, se esistono rami arteriosi che vanno embolizzati, prima di somministrare il radiofarmaco, per evitare effetti collaterali a carico di altri organi. – Quella medico nucleare prevede un momento prima del rilascio del farmaco radioembolizzante e uno successivo ad esso
Approfondimento 2
L’embolizzazione con spirali ha lo scopo di chiudere quelle comunicazioni che porterebbero a depositare il radiofarmaco in sedi indesiderate: tratto gastrointestinale, pancreas. Le arterie che possono essere embolizzate sono la gastroduodenale, l’arteria gastrica destra, arteria gastrica sinistra accessoria, arteria falciforme, arteria frenica, arteria esofagea inferiore, arteria sopraduodenale o retroduodenale., l’arteria cistica. Quest’ultima deve essere sistematicamente embolizzata solo se la scintigrafia dimostri una permanenza del macroaggregato all’interno delle pareti. Lo stesso dicasi dell’arteria falciforme, che può essere embolizzata una volta dimostrata la presenza di macroaggregati; in aggiunta, durante l’intervento si può aggiungere del ghiaccio, posizionato sulla cute, prima della radioembolizzazione, con l’intento di vasocostringere i vasi e limitare i danni. L’embolizzazione potrebbe riguardare anche i vasi arteriosi che potrebbero rifornire il tumore, che originano prossimalmente al punto in cui si è deciso di rilasciare il farmaco, che garantirebbero una ripresa della malattia. Lo scopo è quello di centralizzare il sangue arterioso al tumore e quindi anche il rilascio del radiofarmaco. Ancora in discussione è la tempistica della embolizzazione: effettuarla al momento dello studio preparatorio o all’atto dell’intervento. Maggiore è il tempo che intercorre tra i due atti, maggiore la possibilità che si sviluppino circoli collaterali, che possono favorire il rilascio del radiofarmaco in sedi indesiderate. Inoltre, il paziente, nonostante l’embolizzazione, potrebbe essere scartato dal successivo trattamento, per la presenza di comunicazioni tra il fegato e il polmone, superiori al 30%, oppure per la comparsa di pericolosi shunt intraepatici. Esistono alcuni metodi per conferire maggiore sicurezza all’intervento e il rilascio del radiofarmaco: la cone-beam TC, lo studio del flusso arterioso epatico, l’impiego di angiotensina, l’uso di particelle embolizzanti degradabili. La cone beam TC permette di valutare dove viene rilasciato il radiofarmaco, sulla base della distribuzione del mezzo di contrasto, iniettato in una determinata arteria, con la rappresentazione topografica della sua distribuzione. Teoricamente, questo artificio potrebbe limitare il numero di embolizzazioni, se si prova che quei rami non concorrono all’irrorazione del tumore. La presenza di rami parassitari o di varianti anatomiche deve essere eliminata con l’embolizzazione, in modo da fare convergere il flusso arterioso in un’unica direzione: centralizzazione del flusso arterioso. Farmaci vasodilatatori possono incrementare il flusso arterioso alla lesione epatica da trattare, ma potrebbero avere anche pericolosi effetti sistemici sulla pressione del paziente. L’impiego di particelle embolizzanti biodegradabili è stato effettuato in un ristretto numero di pazienti; lo studio TC, dopo la loro somministrazione del radiofarmaco, ha dimostrato il risparmio del parenchima epatico sano. E’ un campo ancora da valutare
Approfondimento 3
La sindrome da post-embolizzazione comprende un affaticamento facile,
stanchezza, dolore addominale. Meno grave rispetto ad altre forme di terapia
loco-regionale, incide in un 20-70% dei
casi. Raramente comporta un allungamento dei tempi di degenza. Molto spesso i
sintomi, se si prolungano oltre 2 giorni, possono essere affrontati in day
hospital. . La nausea, con perdita di appetito, senza modificazione delle
abitudini alimentari, comporta una diminuzione del cibo assunto per via orale,
senza sensibile perdita di peso Difficilmente l’inadeguato apporto calorico
determina la necessità di supporto
idrico, o di un sondino nasogastrico. Queste tre situazioni rappresentano
progressivamente la gravità clinica del sintomo, inizialmente controllabile
farmacologicamente con antiermetici.- Uno o due episodi di vomito, al termine
dell’intervento, nelle prime 24 ore, rientrano nella norma- Tre o cinque
episodi nell’arco delle 24 ore indicano un danno gastrico o duodenale. Oltre
tale limite è consigliabile il ricovero, per effettuare una terapia continua. –
La diarrea può essere un fenomeno
isolato, o limitato alle prime 24 ore; se dovesse persistere e aumentare
d’intensità, occorre escludere un danno serio al colon. – La pancreatite può essere limitata ad un temporaneo
incremento dei livelli degli enzimi, lipasi, amilasi, che tornano nella norma
nell’arco di 72ore. La persistenza
dell’innalzamento degli enzimi, associato a dolore epigastrico notevole, vomito
e diarrea deve fare pensare ad un serio danno. La TC aiuta a confermare tale quadro
clinico. La terapia è solo conservativa.
Il dolore addominale può essere
generalizzato oppure limitato al quadrante addominale superiore destro;
facilmente controllabile con antiinfiammatori non steroidei, può arrivare a
richiedere anche oppiacei
Approfondimento 4
La disfunzione epatica e le sequele biliari. L’insufficenza epatica è difficile da valutare, se coesisteva anche prima del trattamento. In genere, nei pazienti cirrotici, una classe di Child C, punteggio uguale o superiore a 10, è una controindicazione all’intervento. Un livello di bilirubina > 2 mg/dl indica un candidato non ideale. Nei pazienti con metastasi il parenchima epatico è in genere normale, per cui gli indici di funzionalità epatica possono non essere alterati; tale situazione può modificarsi, se la massa tumorale supera il 50% del fegato. Una insufficienza epatica indotta dall’attività radiante è abbastanza rara, ma possibile; è stata registrata in un 4% dei pazienti. Sebbene l’effetto ischemico di tali particelle sia minimo, in questi casi la dose radiante ha colpito anche il parenchima sano. Per tale motivo, la ripetizione dell’intervento di radioembolizzazione è un importante fattore di rischio per lo sviluppo di tale complicazione; sebbene non sia impossibile, occorre un lasso di tempo, prima di poterla effettuare di nuovo. Anche una pregressa radioterapia può predisporre il fegato ad una insufficienza epatica, in relazione alla dose somministrata e alla superficie esposta. Una volta manifestata, l’insufficienza va tenuta sotto controllo, con prelievi ematici settimanali, per verificare la validità della terapia e la ripresa del parenchima; una eventuale agobiopsia può servire a confermare la validità della diagnosi. In genere, il 58% dei trattamenti comporta un certo grado di tossicità epatica, che si normalizza nell’arco di 1 mese. Una condizione pre-esistente di fibrosi epatica o di ipertensione portale non rappresentano una controindicazione all’intervento. Ma lo sviluppo di una ipertensione portale, specie se si effettua un trattamento bilobare, è una possibile complicazione, visibile radiologicamente [ipertrofia della milza e atrofia del parenchima epatico – una manifestazione clinica di tale condizione, con piastrinopenia e/o sanguinamento da varici è un’evenienza rara]. La radioembolizzazione può essere effettuata anche in pazienti con TIPS; lesioni biliari saranno riscontrabili in un 25% di casi. Un paziente in stadio OKUDA I può sopportare fino a 390 Gy, senza complicazioni; tale livello scende a 190 Gy, in caso di OKUDA II. Una malattia epatica indotta dalla radioembolizzazione è presente maggiormente nei pazienti anziani, in quelli dove l’intervento ha coinvolto tutto o oltre il 75% del fegato e in coloro che partivano con elevati livelli di bilirubina. – Le sequele biliari rappresentano una seria complicazione della ardioembolizzazione. L’incidenza complessiva non supera il 10%; può essere messa in relazione all’effetto ischemico delle particelle radianti [una necrosi biliare può essere presente in un 6% dei casi, la formazione di un biloma in un 1% dei casi, la colecistite e la formazione di calcoli in un 1% dei casi, la formazioni di stenosi in un 2% dei pazienti – la colecistite può essere prevenuta, riconoscendo l’arteria cistica ed embolizzandola, prima d’iniettare il radiofarmaco – la colangite si manifesta con febbre, dolore al quadrante addominale superiore destro e ittero. L’antibioticoterapia è l’unica soluzione]. Tali effetti collaterali aumentano nei pazienti con pregresso intervento bilio-enterico, o tra coloro che hanno effettuato più cicli di chemioterapia; viceversa vengono registrati meno tra i pazienti cirrotici. La comparsa di dolore comporta l’effettuazione d’indagini diagnostiche per immagini, che svelano precocemente tali condizioni
Approfondimento 5
Le complicazioni a livello polmonare. In questa sede, le polmoniti post intervento sono molto rare, ma aumentano con la presenza di uno shunt superiore al 13%. La scintigrafia è sufficiente a documentare l’esistenza di tali comunicazioni, anche se la PET/TC è meglio. E’ stata riportata una disfunzione ventilatoria restrittiva, dopo l’intervento
Approfondimento 6
Le complicazioni a livello gastro-duodenale. A livello gastrointestinale, si possono
verificare un 4% di danni gastroduodenali, mentre le ulcerazioni visibili
all’endoscopia possono arrivare al 29%. Il motivo è da ricondursi all’esistenza
di anastomosi arteriose epato-enteriche,
con conseguente deposizione non desiderata di microsfere radiattive. L’embolizzazione
preventiva con microspirali dell’arteria gastroduodenale e dell’arteria
gastrica destra prevengono tali complicazioni; lo studio arteriografico
dell’arteria epatica sinistra, in fase precoce, serve a documentare eventuali
connessioni con l’arteria gastrica sinistra o con le esofagee inferiori; in
fase tardiva serve ad escludere eventuali comunicazioni con la vena
coronarica. Lo studio selettivo
dell’arteria epatica destra serve ad identificare le arterie sopraduodenali e
quelle retroportali.
Nonostante ciò, anche la giovane età del paziente, una origine distale
dell’arteria gastroduodenale e la posizione troppo prossimale del microcatetere
a tale arteria rappresentano dei fattori di rischio. Una complicazione
dell’embolizzazione potrebbe essere lo sviluppo di un circolo collaterale, durante
il tempo che il paziente aspetta l’arrivo della dose di radioembolizzante; per
questo alcuni autori non effettuano più l’embolizzazione nella fase di studio,
ma in quella terapeutica
Approfondimento 7
Le altre complicazioni. Una dermatite in sede periombelicale può essere secondaria al passaggio di microsfere, attraverso le comunicazioni con l’arteria falciforme e la parete anteriore dell’addome. Anche in questo caso, l’embolizzazione preliminare è fortemente consigliata. L’applicazione di pomate vasocostrittrici rappresentano un palliativo. – La linfopenia transitoria è stata registrata con il trattamento delle sfere di vetro; ma non sono state registrate infezioni opportunistiche
Approfondimento 8
Le complicazioni legate al mezzo di contrasto. La nefropatia da mezzo di contrasto è possibile, se il paziente parte già con dei parametri alterati. L’idratazione pre e post intervento rappresentano l’unica soluzione. Le reazioni allergiche al mezzo di contrasto possono essere prevenute e/o controllate con l’impiego di antistaminici e cortisone
Approfondimento 9
Le lesioni vascolari. Le lesioni vascolari possono essere prevenute, utilizzando alcune accortezze. Innanzi tutto occorre la conoscenza delle precedenti terapie sistemiche e loco-regionali. Poi la visione dello studio TC, con le ricostruzioni, per conoscere bene l’anatomia vascolare. Infatti, la dissezione è più frequente se il paziente ha utilizzato il bevacizumab, che rende i vasi più friabili, più proni alla dissezione o alla rottura. L’unica possibilità di prevenire tali complicazioni è l’utilizzo di microcateteri con fili guida, da utilizzare con cautela. Inoltre, il massimo ingrandimento dell’immagine e l’avanzamento del filo guida con estrema gentilezza aiutano a limitare tali fenomeni. Una eventuale dissezione nell’accesso femorale, può essere risolta con uno stent e una terapia antiaggregante. Una dissezione a livello epatico obbliga ad interrompere l’intervento, se non è controllabile al momento
Approfondimento 10
Le valutazioni post-intervento. A livello di laboratorio, andranno richiesti gli e sami generali e quelli della funzionalità epatica e renale. La prima manifestazione è il dolore addominale, in relazione al numero di particelle iniettate. La seconda è la comparsa della sindrome da post-embolizzazione: febbricola, nausea, affaticamento Il dosaggio dei markers tumorali contribuisce a chiarire la risposta del paziente alla terapia, oltre ad identificare, precocemente, una persistenza o una ripresa di malattia. Si effettua a 3 giorni dall’intervento, a 15 giorni, a 30 e a 90 giorni. Per la valutazione radiologica, il controllo TC e/o RM va programmato a 3 mesi. Infatti, una TC al primo mese potrebbe documentare che la lesione trattata è aumentata di dimensioni, per il persistere dei fenomeni infiammatori. Al terzo mese, viceversa si assiste al risultato dell’intervento: si dovrebbe documentare il decremento volumetrico della lesione. Fondamentale è però la necrosi della lesione, presente sin dall’inizio. – la PET/TC oltre a documentare l’attività della malattia, aiuta ad identificare eventuali dosi di radiofarmaco migrate accidentalmente in duodeno